El concepte de hibridació es defineix com el procés de combinar dos orbitals atòmics per crear un nou tipus d'orbitals hibridats. Aquesta barreja normalment dóna lloc a la formació d'orbitals híbrids amb energies, formes, etc. completament diferents. La hibridació es realitza principalment per orbitals atòmics del mateix nivell d'energia. Tanmateix, tant els orbitals completament plens com els mig omplerts poden participar en aquest procés si les seves energies són iguals. El concepte d'hibridació és una extensió de la teoria de l'enllaç de valència que ens ajuda a entendre la formació d'enllaços, les energies d'enllaç i la longitud dels enllaços.
Què és la hibridació?
Quan dos orbitals atòmics es combinen per formar un orbital híbrid en una molècula, l'energia dels orbitals dels àtoms individuals es redistribueix per donar orbitals d'energia equivalent. Això es coneix com a hibridació.
mapes java
Els orbitals atòmics d'energies comparables es barregen durant el procés d'hibridació, que consisteix principalment en la fusió de dos orbitals o dos orbitals 'p' o la barreja d'un orbital 's' amb un orbital 'p' així com una 's'. orbital amb un orbital 'd'.
Orbitals híbrids són els nous orbitals formats com a resultat d'aquest procés. Més important encara, els orbitals híbrids es poden utilitzar per explicar les propietats d'enllaç atòmic i la geometria molecular. El carboni, per exemple, forma quatre enllaços simples en els quals l'orbital s de la capa de valència es combina amb tres orbitals p de la capa de valència. Aquesta combinació genera quatre sp equivalents3mescles. Aquests estaran disposats en un patró tetraèdric al voltant del carboni, que està unit a quatre àtoms diferents.
Passos per determinar el tipus d'hibridació
Per entendre el tipus d'hibridació en un àtom o un ió, s'han de seguir les regles següents.
- En primer lloc, determineu el nombre total d'electrons de valència continguts en un àtom o ió.
- A continuació, compta el nombre de parells solitaris units a aquest àtom o ió.
- Ara, el nombre d'orbitals necessaris es pot calcular sumant el nombre de dúplex o octet i el nombre de parells d'electrons solitaris.
- Cal tenir en compte que la geometria dels orbitals en àtoms o ions és diferent quan no hi ha un parell d'electrons solitari.
Característiques de la hibridació
- La hibridació es produeix entre orbitals atòmics amb energies iguals.
- El nombre d'orbitals híbrids formats és igual al nombre d'orbitals atòmics que es barregen.
- No és necessari que tots els orbitals mig plens participin en la hibridació. Fins i tot els orbitals que estan completament plens però tenen una energia lleugerament variable poden participar.
- La hibridació es produeix només durant la formació d'enllaços, no en un sol àtom gasós.
- Si es coneix la hibridació de la molècula, es pot predir la forma de la molècula.
- El lòbul més gran de l'orbital híbrid és sempre positiu, mentre que el lòbul més petit del costat oposat és sempre negatiu.
Tipus d'hibridació
La hibridació es pot classificar com sp3, sp2, sp., sp3d, sp3d2, o sp3d3en funció dels tipus d'orbitals implicats en la mescla.
sp Hibridació
Es produeix quan un orbital s i un p de la capa principal d'un àtom es combinen per formar dos nous orbitals equivalents. Els orbitals recentment formats es coneixen com a orbitals hibridats sp. Produeix molècules lineals amb un angle de 180°. Implica combinar el propi orbital i un orbital 'p' d'igual energia per produir un nou orbital híbrid conegut com a orbital hibridat sp.
- També es coneix com a hibridació diagonal.
- Cada orbital hibridat sp conté la mateixa quantitat de caràcters s i p.
- Tots els compostos de beril·li, com BeF2, Bé2, i BeCl2, són exemples.

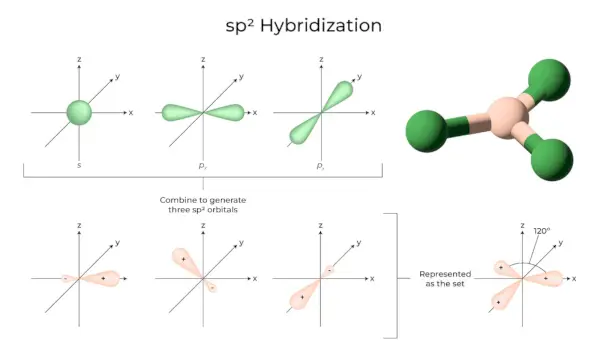
sp2Hibridació
Es produeix quan un s i dos orbitals p de la capa d'un mateix àtom es combinen per formar tres orbitals equivalents. Els orbitals recentment formats es coneixen com sp2orbitals híbrids. També es coneix com a hibridació trigonal. Implica combinar el propi orbital amb dos orbitals 'p' d'igual energia per crear un nou orbital híbrid conegut com a sp.2. Una barreja de simetria trigonal d'orbitals s i p es manté a 120 graus. Els tres orbitals híbrids romanen en el mateix pla i formen un angle de 120° entre si.
- Cada orbital híbrid format té un caràcter 'p' del 33,33% i del 66,66%.
- Les molècules de forma plana triangular tenen un àtom central que està lligat a tres àtoms més i és sp2hibridat. Els compostos de bor en són exemples.
sp3Hibridació
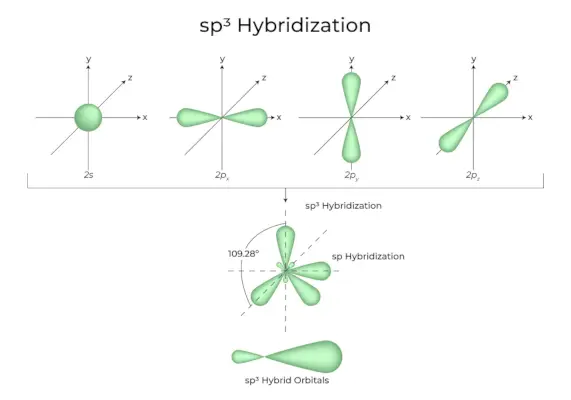
Quan un orbital 's' i tres orbitals 'p' de la mateixa capa d'un àtom es combinen per formar quatre nous orbitals equivalents, la hibridació es coneix com a hibridació tetraèdrica o sp.3. Els orbitals recentment formats es coneixen com sp3orbitals híbrids. Aquests s'apunten a les quatre cantonades d'un tetraedre regular i formen un angle de 109°28′ entre ells.
- El sp3Els orbitals híbrids formen un angle de 109,28 graus.
- Cada orbital híbrid té un caràcter s del 25% i un caràcter p del 75%.
- L'etan i el metà són dos exemples.
sp3d Hibridació
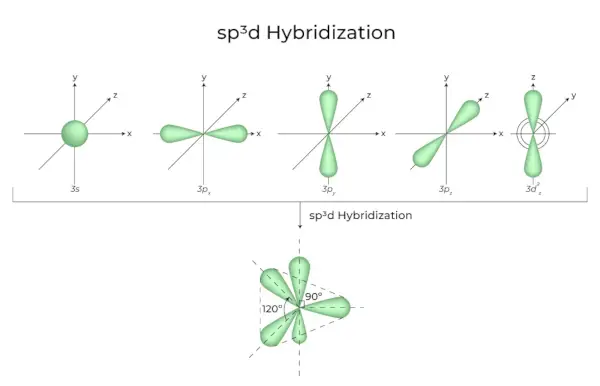
La barreja d'orbitals 1s, orbitals 3p i orbitals 1d dóna com a resultat 5 orbitals hibridats sp3d d'igual energia. La seva geometria és trigonal bipiramidal. La combinació d'orbitals s, p i d dóna com a resultat una simetria bipiramidal trigonal. Els orbitals equatorials són tres orbitals híbrids que estan orientats en un angle de 120° entre si i es troben en el pla horitzontal.
- Els dos orbitals restants, coneguts com a orbitals axials, es troben en el pla vertical a 90 graus dels orbitals equatorials.
- Hibridació en pentaclorur de fòsfor, per exemple (PCl5).
sp3d2 Hibridació
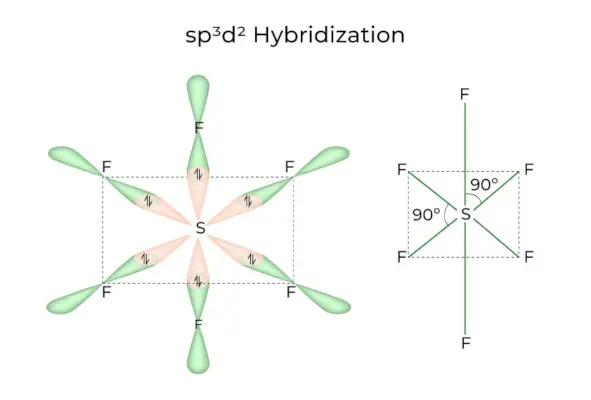
Quan els orbitals 1s, 3p i 2d es combinen per formar 6 sp idèntics3d2orbitals híbrids, la hibridació s'anomena sp3d2Hibridació. Aquests set orbitals apunten a les cantonades d'un octaedre. Estan inclinats en un angle de 90 graus entre ells.
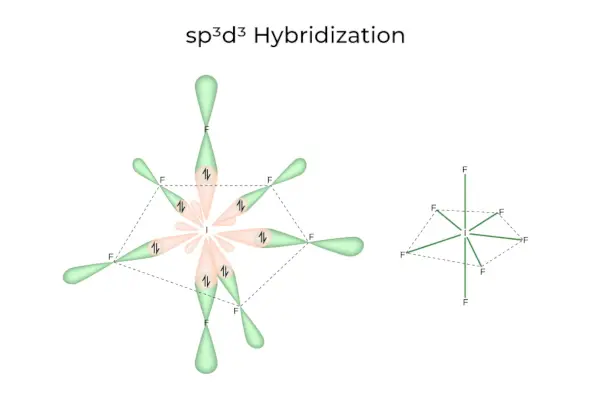
sp3d3Hibridació
Té orbitals 1s, 3p i 3d, que es combinen per formar 7 sp idèntics3d3orbitals híbrids. Aquests set orbitals apunten a les cantonades d'una bipiramidal pentagonal. per exemple. SI6.
Formes d'hibridació
- Lineal : La hibridació sp és causada per la interacció de grups de dos electrons; l'angle orbital és de 180°. Planar trigonal: hi intervenen tres grups d'electrons, donant lloc a sp2hibridació; els orbitals estan separats 120°. Tetraèdric: hi intervenen quatre grups d'electrons, donant lloc a sp3hibridació; l'angle orbital és de 109,5°. Bipiramidal trigonal: hi intervenen cinc grups d'electrons, donant lloc a sp3d hibridació; els angles orbitals són de 90° i 120°. Octaèdric: hi intervenen sis grups d'electrons, donant lloc a sp3d2hibridació; els orbitals estan separats de 90°.
Preguntes freqüents sobre Hibridació
Pregunta 1: entre sp, sp2 i sp3, quin orbital híbrid és més electronegatiu?
Resposta:
matriu java ordenada
El percentatge de caràcter s en sp, sp2, i sp3El carboni hibridat és del 50%, 33,33% i 25%, respectivament. A causa de la forma esfèrica de l'orbital s, és atret de manera uniforme des de totes les direccions pel nucli. Com a resultat, un orbital híbrid de caràcter s estarà més a prop del nucli i, per tant, més electronegatiu. Com a resultat, el carboni hibridat sp és el més electronegatiu.
Pregunta 2: Què són els orbitals híbrids?
Resposta:
Els orbitals híbrids es formen combinant orbitals atòmics estàndard i donant lloc a la formació de nous orbitals atòmics.
Pregunta 3: Quines són les cinc formes d'hibridació?
Resposta:
Lineal, trigonal plana, tetraèdrica, trigonal bipiramidal i octaèdrica són les cinc formes bàsiques d'hibridació.
Pregunta 4: Per què la molècula d'amida sembla sp3hibridat però és sp2?
jquery aquest clic
Resposta:
Si l'àtom està tancat per dos o més orbitals p o té un parell solitari capaç de saltar a un orbital p, el procés general d'hibridació canviarà. Com a resultat, en el cas d'una molècula d'amida, el parell solitari entra en un orbital p, donant lloc a tres orbitals p paral·lels adjacents.
Pregunta 5: Quina és la regla de Bent?
Resposta:
Un àtom central connectat a nombrosos grups d'una molècula s'hibridarà, fent que els orbitals amb més caràcter s es dirigeixin cap a grups electropositius i els orbitals amb més caràcter p es dirigiran cap a grups electronegatius.
