El principi d'Aufbau és el mètode bàsic que ens indica com s'omplen els electrons a l'orbital atòmic. Segons el principi d'Aufbau, l'ompliment dels electrons en l'estat fonamental d'un àtom segueix un patró bàsic. Aquest principi ens diu que els electrons de l'orbital atòmic de qualsevol àtom s'omplen en l'ordre ascendent de la seva energia i per trobar l'energia de l'orbital atòmic segueixen la regla n+l.
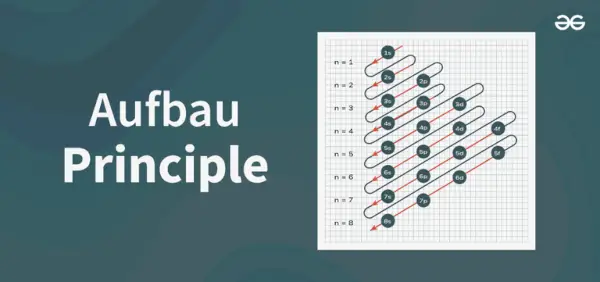
Principi d'estructura
En aquest article, coneixerem en detall el principi d'Aufbau, les característiques del principi d'Aufbau, les seves excepcions i limitacions.
Definició del principi d'estructura
El principi d'Aufbau ho diu
Els electrons dels diferents orbitals s'omplen en l'ordre creixent de la seva energia, és a dir, l'orbital amb l'energia més baixa s'omplirà primer i l'orbital amb l'energia més alta s'omplirà el darrer.
La paraula 'Aufbau' en alemany significa 'construir'. La formació d'orbitals significa omplir els orbitals amb electrons. Afirma que els electrons dels orbitals atòmics s'omplen en l'ordre ascendent de l'energia de l'orbital atòmic. I l'energia de l'orbital atòmic es calcula utilitzant la regla n+l que estableix si l'electró amb un nombre més gran del valor n+l té l'energia més gran. En la regla comentada a la línia anterior, n indica el nombre quàntic principal i l indica el nombre quàntic azimutal.
Si dos electrons tenen el mateix valor de n+l, llavors l'electró amb un valor menor de n té la menor energia i s'omple primer. A continuació s'explica l'ordre d'ompliment dels electrons en un orbital atòmic.
Estructura del diagrama de principis
El diagrama del principi d'Aufbau és el diagrama que representa l'ordre d'ompliment dels electrons en un àtom.
java concatenar cadenes
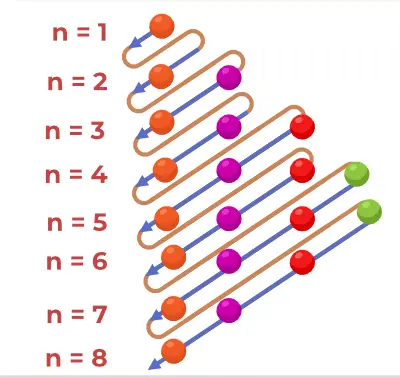
Estructura del diagrama de principis
Estructura de la fórmula del principi
La fórmula del principi d'Aufbau és la fórmula que indica l'ordre en què s'omplen els electrons a l'orbital atòmic. La fórmula de l'orbital atòmic és
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Estructura de la classe de principis 11
El principi d'Aufbau és un principi important de Química per als estudiants de la classe 11. Aquest principi estableix que,
Els electrons de l'orbital atòmic d'un àtom s'omplen en l'ordre ascendent de l'energia de l'orbital atòmic que es calcula mitjançant la regla (n+l).
Dibuix de l'esquema d'estructura
El diagrama d'Aufbau es dibuixa mitjançant els passos afegits a continuació,
- Troba el nombre d'electrons que s'han d'omplir en els àtoms.
- Sabem que en un àtom el
- L'orbital s pot contenir un màxim de 2 electrons.
- L'orbital p pot contenir un màxim de 6 electrons.
- L'orbital d pot contenir un màxim de 10 electrons.
- L'orbital f pot contenir un màxim de 14 electrons.
- Omple els dos primers electrons de l'orbital 1s.
- A continuació, seguiu la regla n+l i després ompliu els electrons en conseqüència.
Característiques destacades del principi d'estructura
Diverses característiques del principi d'Aufbau són,
- L'energia d'un orbital depèn de la suma dels valors del nombre quàntic principal (n) i del nombre suma azimutal (I). Això s'anomena el (n + l) regla . Segons aquesta norma,
- En un àtom aïllat neutre, com més baix sigui el valor de (n + l) per a un orbital, menor serà la seva energia. Tanmateix, si dos tipus diferents d'orbitals tenen el mateix valor (n + l), aleshores els orbitals amb un valor inferior de n tenen menys energia.
| Tipus d'orbital | Valor de n | Valor de l | Valor de n+l | Energia relativa |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Energia més baixa |
| 2s | 2 | 0 | 2+0 = 2 | Energia superior a l'orbital 1s |
| 2p 3s | 2 3 | 1 0 | 2+1 = 3 disseny singleton 3+0 = 3 | Els orbitals 2p (n=2) tenen menor energia que l'orbital 3s(n=3). |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Els orbitals 3p (n=3) tenen menys energia que els orbitals 4s(n=4). |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | Els orbitals 3d (n=3) tenen menys energia que els orbitals 4p(n=4). |
De la descripció que es fa a la taula, es dedueix que les energies dels diferents orbitals augmenten amb l'augment del nombre del nombre quàntic principal.
- Així, l'ordre en què s'omplen els electrons a l'orbital atòmic de la àtom és, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Configuració electrònica utilitzant el principi d'Aufbau
El configuració electrònica A continuació es discuteix l'ús del principi d'Aufbau per a alguns elements:
Configuració electrònica del sofre
Nombre atòmic de sofre és 16, és a dir, té 16 electrons
xor en c++
Ara fent servir el principi d'Aufbau, la configuració electrònica del sofre s'escriu com,
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Configuració electrònica del nitrogen
El nombre atòmic de nitrogen és 7, és a dir, té 7 electrons
Ara, utilitzant el principi d'Aufbau, la configuració electrònica del nitrogen s'escriu com:
[N] = 1s 2 2s 2 2p 3
Excepcions al principi de construcció
Hi ha algunes excepcions al principi d'Aufbau que són el crom i el coure. La seva configuració electrònica és,
Configuració electrònica de crom
La configuració electrònica de Chromium segons el principi d'Aufbau hauria de ser
- Cr(24): [Ar]3d 4 4s 2
Però la configuració anterior no és correcta perquè la configuració electrònica real de Chromium (Cr) és,
- Cr(24): [Ar]3d 5 4s 1
El motiu d'aquesta configuració electrònica és que el L'orbital d-atòmic mig ple és més estable que l'orbital ple d'acord amb el principi d'Aufbau.
Configuració electrònica de coure
La configuració electrònica del coure segons el principi d'Aufbau hauria de ser,
- Cu(29): [Ar]3d 9 4s 2
La configuració anterior no és correcta perquè la configuració electrònica real de coure (Cu) és,
- Cu(29): [Ar]3d 10 4s 1
El motiu d'aquesta configuració electrònica és que el L'orbital d-atòmic ple és més estable que l'orbital ple d'acord amb el principi d'Aufbau.
Llegeix més
- Nombres quàntics
- Forma dels orbitals atòmics
- Estructura atòmica
Principi d'estructura - Preguntes freqüents
Què és el principi d'Aufbau en química?
El principi d'Aufbau en química és el principi bàsic que s'utilitza per omplir els electrons dels orbitals atòmics de qualsevol àtom. Aquest teorema ens indica l'ordre en què s'omplen els electrons a l'orbital atòmic.
Qui va donar el principi d'Aufbau?
El principi d'Aufbau va ser donat pel famós físic danès Niels Bohr l'any 1920.
Quin és el principi d'exclusió de Pauli?
El principi d'exclusió de Pauli estableix que en un àtom no hi ha dos electrons que tinguin els quatre nombres quàntics. t ell mateix. Almenys, un dels nombres quàntics és diferent per a tots els electrons de l'àtom.
com descarregar vídeos de youtube vlc
Què és la regla n+l?
La regla n+l és la regla que diu que l'energia d'un orbital depèn de la suma del nombre quàntic principal (n) i el nombre quàntic azimutal (l). aquesta regla s'anomena regla (n+l).
Quines són les excepcions al principi d'Aufbau?
L'excepció al principi d'Aufbau són,
- Configuració electrònica de crom Cr[24]
- Configuració electrònica de coure Cu[29]
