Orbitals atòmics , que són funcions matemàtiques, descriuen el comportament ondulatori dels electrons (o parells d'electrons) en un àtom. Els orbitals atòmics tenen diferents formes segons el seu tipus. Les diferents formes dels orbitals atòmics descriuen que hi ha la probabilitat més alta o nul·la de trobar un electró al voltant del nucli en algunes direccions. Hi ha quatre tipus d'orbitals, cadascun amb una forma diferent i representats per les lletres s, p, d i f. Es tenen en compte els orbitals s i p perquè són els més abundants en química química i biològica. An orbital s té un nucli esfèric al centre, a orbital p té forma de manuelles, i quatre dels cinc orbitals d tenen forma de trèvol. El cinquè orbital d està dissenyat com una manuella llarga amb un donut al centre. Els orbitals d'un àtom s'organitzen en capes o capes d'electrons.
Què són els orbitals atòmics?
Els orbitals atòmics són l'espai tridimensional proper al nucli d'un àtom on la possibilitat de descobrir un electró és màxima.
Un àtom, segons el model atòmic quàntic, pot tenir un nombre infinit d'orbitals. Aquests orbitals es poden classificar segons la seva mida, forma o orientació. Un orbital més estret significa que hi ha una millor probabilitat d'atrapar un electró a prop del nucli. La funció d'ona orbital sovint es coneix com a funció matemàtica que s'utilitza per expressar les coordenades d'un electró. La probabilitat de localitzar un electró es representa pel quadrat de la funció d'ona orbital. Aquesta funció d'ona també ajuda a la creació de diagrames de superfície límit.
Funció d'ona orbital
El model atòmic quàntic prediu que un àtom pot tenir una gran varietat d'orbitals. Aquests orbitals es poden agrupar segons la seva mida, geometria o inclinació. Una mida orbital reduïda augmenta la probabilitat d'obtenir un electró a prop del nucli. La funció matemàtica utilitzada per representar les coordenades d'un electró s'anomena funció d'ona orbital . La probabilitat de descobrir un electró es representa pel quadrat de la funció d'ona orbital.
També podem utilitzar aquesta funció d'ona per crear diagrames de superfície límit. Podem comprendre millor la forma dels orbitals utilitzant diagrames de superfície límit de la densitat de probabilitat constant per a diversos orbitals.
botó al centre css
Formes dels orbitals atòmics
Les formes dels orbitals atòmics varien. És a dir, les distribucions de probabilitat dels electrons que descriuen al voltant del nucli són diferents. El fet que és probable que els electrons de diferents orbitals estiguin situats en diferents àrees al voltant del nucli pare i, per tant, experimentin l'atracció d'aquest últim amb diferents forces és una de les raons per les quals els orbitals varien en energia. És sorprenent que tots els orbitals d'una capa donada de l'àtom d'hidrogen tinguin la mateixa energia tot i que tenen formes variades. Això es deu a l'eliminació de diverses aportacions relacionades amb l'energia.
Però tan bon punt hi ha un segon electró, la degeneració desapareix.
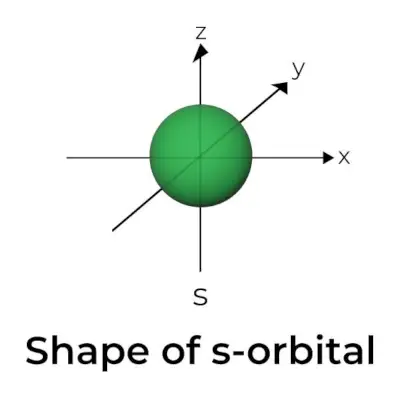
Forma de l'orbital s
- El diagrama de superfície límit orbital s s'assembla a una esfera amb el nucli al centre, que es pot mostrar en dues dimensions com un cercle.
- Els orbitals s són esfèricament simètrics, el que significa que la probabilitat de trobar un electró a una distància determinada és la mateixa en totes les direccions.
- També es mostra que la mida de l'orbital s augmenta a mesura que augmenta el valor del nombre quàntic primari (n); per tant, 4s> 3s> 2s> 1s.
- El punt nodal és un lloc on no hi ha possibilitat de localitzar l'electró. Els nodes es classifiquen en dos tipus: nodes radials i nodes angulars. La distància des del nucli es calcula pels nodes radials, mentre que l'orientació està determinada pels nodes angulars.
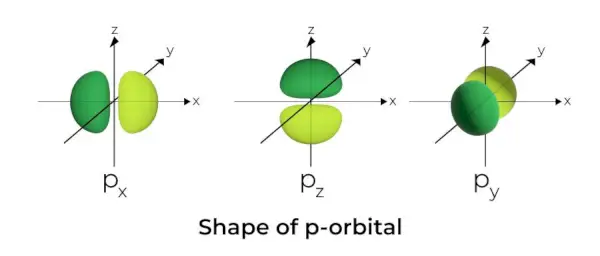
Forma de l'orbital p
- Els orbitals p es formen com a manuelles.
- El node orbital p es troba al centre del nucli.
- A causa de la presència de tres orbitals, l'orbital p pot ocupar un màxim de sis electrons.
- Cada orbital p està format per dues parts conegudes com a lòbuls que es troben a banda i banda del pla que travessa el nucli.
- Cada orbital p té parts conegudes com a lòbuls a banda i banda del pla que travessa el nucli. En el pla on es creuen els dos lòbuls, la probabilitat de trobar un electró és nul·la.
- Els tres orbitals es coneixen com a orbitals degenerats perquè tenen la mateixa mida, forma i energia.
- L'única diferència entre els orbitals és l'orientació dels lòbuls. Com que els lòbuls estan orientats al llarg de l'eix x, y o z, reben els noms 2px, 2py, i 2pz. La fórmula n –2 s'utilitza per calcular el nombre de nodes.
- De manera similar als orbitals s, la mida i l'energia dels orbitals p augmenten a mesura que augmenta el nombre quàntic primari (4p> 3p> 2p).
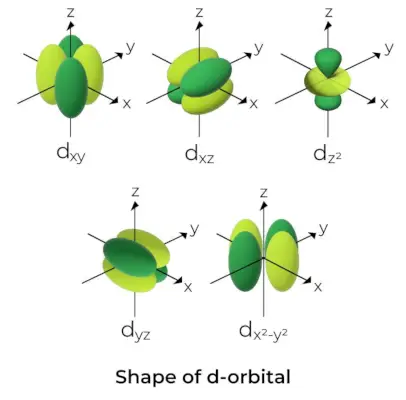
Forma de l'orbital d
- Per als orbitals d, el nombre quàntic de l'orbital magnètic es dóna com a (-2, -1,0, 1,2). Com a resultat, podem afirmar que hi ha cinc orbitals d.
- Aquests orbitals es denoten amb els símbols dxy, dyz, dxz, dx2–i2, i dAmb2.
- Les formes dels quatre primers orbitals d són semblants entre si, cosa que difereix de la dAmb2orbital, però l'energia dels cinc orbitals d és la mateixa.
Forma de l'orbital f
- La forma de l'orbital f està dispersa. Com que el valor de l=3 per a l'orbital f, el valor mínim del nombre quàntic primari n és 4.
- Els valors equivalents en ml per a l'orbital f són (-3,–2, –1, 0, +1, +2, +3).
- Com a resultat, hi ha set orbitals f per l = 3.

nom de caràcters especials
Orbitals degenerats
Els orbitals degenerats són aquells que tenen la mateixa energia. Aquests orbitals són diferents (poden estar orientats de manera diferent a l'espai al voltant de la nucli atòmic ), però tenen la mateixa energia. En presència d'un camp extern, la degeneració de l'orbital p no es veu afectada; tanmateix, la degeneració dels orbitals f i d es pot trencar aplicant un camp extern al sistema (ja sigui camp elèctric o magnètic).
Pocs orbitals tindran més energia, mentre que altres tindran menor energia. La degeneració ja no existirà al sistema. Per exemple, els orbitals d estan formats per cinc orbitals degenerats que tenen tots la mateixa energia.
Llegeix més:
- Teoria de l'orbital molecular
- Ompliment de l'orbital en un àtom
- Hibridació
Preguntes freqüents sobre les formes dels orbitals atòmics
Pregunta 1: Com funcionen els orbitals?
Resposta:
fer executable un script sh
Un orbital atòmic és una expressió matemàtica que expressa el comportament ondulat d'un electró o d'un parell d'electrons en un àtom en teoria atòmica i mecànica quàntica. Cada orbital ocuparà un màxim de dos electrons, cadascun amb la seva pròpia quantitat d'espín.
Pregunta 2: Què és el pla nodal?
Resposta:
El pla on la probabilitat de trobar un electró és insignificant o zero s'anomena pla nodal.
Pregunta 3: Quants orbitals hi ha?
Resposta:
Com que el subnivell s només té un orbital, només poden estar presents dos electrons. Com que el subnivell p comprèn tres orbitals, poden estar presents un màxim de sis electrons. Com que el subnivell d comprèn 5 orbitals, poden estar presents un màxim de 10 electrons. I cadascun dels quatre subnivells té set orbitals que poden contenir un màxim de 14 electrons.
conté en cadena
Pregunta 4: Quins orbitals tenen més energia?
Resposta:
apilar en java
L'orbital 1s té més energia. L'energia d'un electró és la quantitat d'energia necessària per treure'l de la bombolla elèctrica de l'àtom.
Pregunta 5: Quina diferència hi ha entre una capa i un orbital?
Resposta:
En un àtom, una capa és una col·lecció de subcapa de la mateixa teoria dels nombres quàntics, n. Els orbitals tenen dos electrons cadascun, i els electrons del mateix orbital tenen la mateixa definició de mida, mida del moment angular i nombre quàntic magnètic.
Pregunta 6: Què és l'enllaç sigma i pi?
Resposta:
La superposició d'orbitals atòmics crea enllaços sigma i pi. Els enllaços Sigma es creen superposant-se els lòbuls orbitals atòmics, mentre que els enllaços Pi es generen quan un lòbul orbital atòmic se superposa a un altre.
