La base és un compost químic format per OH–ions i accepta protons. Bases en Química són aquells compostos que es tornen blaus de tornasol vermell i quan reaccionen amb àcid neutralitzen la reacció per donar sal i aigua. El valor de pH de la base és superior a 7. Les bases tenen un gust amarg i un tacte relliscós. Les bases que són solubles en aigua s'anomenen àlcalis. Exemples de bases són els òxids metàl·lics, els hidròxids metàl·lics, etc. El sabó és un exemple de base que fem servir a la vida diària. En aquest article, coneixerem en detall la definició, les propietats i les reaccions químiques de les bases.

Definició base
La base es defineix com el compost químic el valor de pH del qual és superior a 7, accepta un protó, neutralitza l'àcid i torna el tornasol vermell a blau. Generalment alliberen OH–ió sobre la dissociació. Alguns exemples inclouen NaOH, NaHCO3,etc. A continuació es mostren algunes característiques generals que mostra la base:
- Tenen un gust amarg
- Són relliscosos al tacte
- Es tornen blaus tornasol vermell
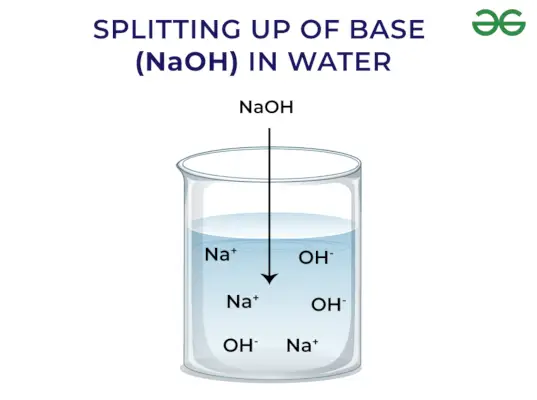
- Alliberen OH–ió quan es dissol en aigua
- Condueixen l'electricitat en forma de solució
Les bases són un dels compostos químics més importants que s'utilitzen a la vida quotidiana. Les bases s'utilitzen com a antiàcid per controlar l'acidesa i en pasta de dents per neutralitzar l'acció bacteriana que produeix àcid a la nostra boca i evita la degradació de l'esmalt i la cavitat. També s'utilitzen com a llevat en pols, bicarbonat de sodi i rentadora.
Base Lewis
Les bases de Lewis són els compostos que tenen parells d'electrons i poden donar-los als compostos que són deficients en parells d'electrons. Les bases de Lewis són de naturalesa nucleòfila, és a dir, són amants dels nuclis, el que significa que atacaran un centre carregat positivament amb els seus parells d'electrons. Exemples de base de Lewis inclouen l'amoníac perquè a l'amoníac (NH3) l'àtom central El nitrogen té 5 electrons dels quals 3 s'utilitzen per fer enllaços amb 3 àtoms d'hidrogen i un parell d'electrons queda amb l'àtom de N, fent així NH3una base Lewis.
Base Arrhenius
Segons el concepte d'Arrhenius, les bases són compostos que alliberen ions hidròxid quan es dissolen en aigua i augmenten la concentració d'ions hidroxil a la solució aquosa. Per exemple, quan el KOH es dissol en aigua donarà OH–ió i augmentar així la concentració d'OH–a l'aigua.
Base Bronsted
El concepte de base de Bronsted és una versió avançada del concepte d'Arrhenius que afirma que les bases són compostos que accepten H+ió o protó per formar el seu àcid conjugat. Per exemple Cl–és una base que accepta H+per formar HCl com a àcid conjugat.
Tipus de bases
Les bases es poden classificar en funció de l'acidesa, la concentració i la capacitat d'ionització. La classificació s'esmenta a continuació
Tipus de bases basades en l'acidesa
L'acidesa d'una base es refereix al nombre de grups hidroxil substituïbles presents en una molècula de la base. Segons l'acidesa, les bases es classifiquen en tres categories:
- Base monoàcida
- Base diàcida
- Base triacídica
Monoàcid: Les bases monoàcides són aquelles que contenen només un ió hidroxil substituïble i interaccionen amb només un ió hidrogen. Les bases monoàcides inclouen NaOH, KOH i altres.
seqüència de Fibonacci java
diàcid: La base diàcida és una base amb dos ions hidroxil substituïbles que interaccionen amb dos ions hidrogen. Ca (OH)2, Mg (OH)2, i altres bases diàcides en són exemples.
Triàcid: La base triacídica és un tipus de base que consta de tres ions hidroxil substituïbles i tres ions hidrogen. Les bases triàcides inclouen Al(OH)3, Fe(OH)3, i altres.
Tipus de bases en funció de la seva concentració en solució aquosa
La concentració fa referència a la quantitat de base present en una solució aquosa. Segons la seva concentració en solució aquosa, les bases es divideixen en dues categories:
- Base concentrada
- Base diluïda
Base concentrada: Les bases concentrades són aquelles en què la quantitat de base és gran en comparació amb el dissolvent. Solució concentrada de NaOH, per exemple.
Base diluïda: Aquest tipus de bases tenen una menor concentració de base en la seva solució aquosa. La dilució és el procés de reduir el percentatge d'un solut afegint més quantitat de dissolvent. Per exemple, diluïu NaOH, diluïu KOH, etc.
Tipus de bases segons el grau d'ionització
El grau d'ionització es refereix a la capacitat d'un compost químic per alliberar el seu ió constituent quan es dissol en aigua. En el cas de la base, el grau d'ionització fa referència a la capacitat de la base per alliberar OH–ions quan es dissolen en aigua. Segons el grau d'ionització, les bases es classifiquen en dos tipus:
- Base forta
- Base feble
Base forta: Les bases fortes són aquelles bases que es dissocien completament i alliberen ions OH- quan es dissolen en aigua. Alguns exemples de bases fortes inclouen NaOH, KOH, etc.
Base feble: Les bases que no pateixen una dissociació completa i alliberen només una fracció de l'ió OH- s'anomenen base feble. Exemples de bases febles inclouen Al(OH)3,Cu (OH)2,etc.
Aprèn més, Bases fortes i febles
Propietats de les bases
Com sabem que les bases són compostos químics que tenen ions OH-, es tornen vermells blaus, etc. En aquest apartat, coneixerem les propietats físiques i químiques de les bases juntament amb un breu coneixement de les seves propietats generals.
Propietats Generals de la Base
Les propietats generals de les bases s'esmenten a continuació:
- Un ió hidròxid (OH–) s'allibera a l'aigua per bases. Com més forta es fa la base a mesura que s'alliberen més ions.
- Les bases reaccionen amb l'àcid per formar sal Els àcids reaccionen amb les bases. Aquesta reacció d'una base amb àcid s'anomena reacció de neutralització.
- Les bases es tornen de tornasol vermell a blau.
- L'estructura d'una proteïna pot ser alterada per bases. Les bases tenen aquesta qualitat, que les fa sentir llises. El sabó és una base que es torna increïblement relliscosa a la pell quan està mullada. A causa de la seva capacitat per modificar l'estructura de les proteïnes, algunes bases potents són extremadament perilloses.
Propietats físiques de les bases
Les bases tenen un gust amarg: Les bases són de gust amarg. A causa de la seva amargor, només tenim uns quants aliments alcalins. Només hi ha pocs materials alimentaris alcalins. Les bases s'han de tastar amb més precaució en comparació amb els àcids.
Les bases són relliscoses al tacte: Quan es toquen, les bases se senten relliscoses. Per exemple el sabó.
Les bases alliberen OH – Ió: Quan les bases es dissolen en aigua alliberen ions hidroxil (OH–). Segons la capacitat d'alliberar ions hidroxil, es classifiquen en forts i febles.
Les bases neutralitzen els àcids: Quan les bases reaccionen amb els àcids, es neutralitzen entre si i produeixen sal i aigua. Aquesta reacció s'anomena Reacció de neutralització . Suposem que tenim l'àcid HY i la base 'XOH', aleshores la sal formada serà 'XY'. L'equació d'aquesta reacció es pot donar com a HY + XOH → HOH + XY.
Proteïna desnaturalitzada de bases: La desnaturalització de proteïnes significa la destrucció de l'estabilitat i l'estructura de la proteïna. Això fa que la base sigui perjudicial per als humans, ja que la pell i els cabells humans estan formats per proteïnes i quan s'utilitzen àlcalis forts com l'hidròxid de sodi o potassi també anomenats Lye creen un impacte nociu sobre la pell humana.
sql concat
Les bases converteixen el tornasol vermell en blau: Quan les bases es posen en contacte amb el tornasol vermell, el tornen blau. Tanmateix, cal tenir en compte que aquest canvi no es pot observar quan intentem reaccionar la base seca amb paper tornasol vermell. La prova de paper tornasol és un dels mètodes més antics per provar la base. Tanmateix, també existeixen altres indicadors com la fenolftaleïna
Bases de conducta elèctrica: Quan les bases estan en forma de solució tenen ions OH- mòbils, per tant poden conduir l'electricitat.
Propietats químiques de les bases
- Reacció de base amb metalls: Quan l'àlcali (base) reacciona amb el metall, la sal i l'hidrogen es produeix gas.
Àlcali + Metall → Sal + Hidrogen
Exemples:
- Quan l'hidròxid de sodi interacciona amb el metall d'alumini, es generen aluminat de sodi i hidrogen gasós.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 h 2
- Quan l'hidròxid de sodi interacciona amb el metall de zinc, produeix hidrogen gasós i zincat de sodi.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reacció dels òxids no metàl·lics amb la base: La sal i l'aigua es formen quan els òxids no metàl·lics reaccionen amb una base.
Òxid no metàl·lic + Base → Sal + Aigua
Quan l'hidròxid de calci, una base reacciona amb diòxid de carboni, després es produeix carbonat de calci i aigua.
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reacció d'àlcalis/base amb sals d'amoni: L'amoníac es produeix quan els àlcalis reaccionen amb sals d'amoni.
Àlcali + Sal d'amoni → Sal + Aigua + Amoníac
Quan l'hidròxid de calci reacciona amb el clorur d'amoni, es produeix aigua amb clorur de calci i amoníac.
Ca (OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Exemples de Bases
Les bases generalment són òxid metàl·lic, hidròxid metàl·lic, carbonat d'hidrogen metàl·lic, carbonats metàl·lics, etc. Vegem alguns dels exemples de bases amb la seva aplicació en forma tabular:
| Bases | Aplicacions |
|---|---|
| Hidròxid de potassi KOH | S'utilitza en piles alcalines |
| Hidròxid de sodi NaOH | S'utilitza en la fabricació de sabó i detergent |
| Hidròxid de magnesi Mg (OH) 2 | S'utilitza com a antiàcids |
| Bicarbonat sodi NaHCO 3 error d'atribut python | S'utilitza com a bicarbonat de sodi |
| Carbonat de sodi Ja 2 CO 3 | S'utilitza com a sodi de rentat |
| Amoníac NH 3 | S'utilitza en la fabricació de productes farmacèutics i de neteja |
| Hidròxid de calci Ca (OH) 2 | S'utilitza en rentat blanc teoria dels autòmats |
Usos de les bases
Hi ha diversos casos d'ús de la base, alguns d'ells són:
- L'hidròxid de sodi s'utilitza en la fabricació de sabó i paper. L'hidròxid de sodi (NaOH) també s'utilitza en la producció de raió.
- La pols blanquejadora està feta de Ca (OH)2, conegut comunament com a calç apagada o hidròxid de calci.
- L'hidròxid de calci s'utilitza per crear mescles seques per pintar i decorar.
- L'hidròxid de magnesi, conegut popularment com a llet de magnesia, és un laxant que s'utilitza àmpliament. També s'utilitza com a antiàcid ja que disminueix l'excés d'acidesa a l'estómac humà.
- Als laboratoris, l'hidròxid d'amoni és un reactiu crític.
- La calç apagada es pot utilitzar per neutralitzar l'excés d'acidesa dels sòls.
Llegeix més
- Àcid, base i sal
- Força de l'àcid
- Ionització d'àcids i bases
Preguntes freqüents sobre bases en química
1. Què són les Bases?
- Els compostos bàsics tenen un sabor amarg.
- La textura de la majoria de bases és sabonosa.
- Quan es prova en paper de tornasol, transforma el paper de tornasol vermell en paper de tornasol blau en la majoria dels casos.
- En solució, els compostos bàsics també condueixen l'electricitat.
- Quan els compostos bàsics es dissolen en aigua, s'alliberen ions OH-.
2. Quines són les funcions de les bases?
A casa utilitzem bases com a netejadors i antiàcids. Els sabons, la lleixa (que s'utilitza en netejadors de forn), la llet de magnesi i els Tums són exemples de bases casolanes populars. Cadascun d'ells té un pH superior a set, pot consumir hidrogen lliure i neutralitzar els àcids.
3. Quina és la distinció més important entre un àcid i una base?
Àcids i bases Hi ha dos tipus de productes químics corrosius. Els materials àcids tenen un valor de pH entre 0 i 7, mentre que les bases tenen un valor de pH entre 7 i 14. Els àcids són productes químics iònics que es descomponen a l'aigua per crear l'ió hidrogen (H+) mentre que la base es dissocia per donar ió OH-.
4. Quines són les propietats físiques de les bases?
- Tenen un gust amarg.
- Les seves solucions aquoses tenen una qualitat sabonosa.
- Canvien el color del paper tornasol de vermell a blau.
- Les seves solucions aquoses són conductores de l'electricitat.
- Amb l'alliberament d'hidrogen gasós, les bases reaccionen amb els metalls per generar sal.
5. Què passarà quan l'hidròxid de calci reaccioni amb el clorur d'amoni?
Quan l'hidròxid de calci reacciona amb el clorur d'amoni, es produeix aigua amb clorur de calci i amoníac.
Ca (OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Què passarà quan l'hidròxid de sodi reaccioni amb el zinc metall?
Quan l'hidròxid de sodi interacciona amb el metall de zinc, produeix hidrogen gasós i zincat de sodi.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Què és Lewis Base?
La base de Lewis són els compostos que donen un parell d'electrons al compost deficient d'electrons. L'exemple inclou NH3.
8. De què estan fetes les bases?
Les bases generalment consisteixen en OH–ió. A part d'aquests òxids metàl·lics, també són bases els carbonats i els carbonats d'hidrogen.
9. Què són els àlcalis?
Les bases que són solubles en aigua s'anomenen àlcalis. Un exemple és l'hidròxid de sodi NaOH.
10. Què són la base forta i la base feble?
Les bases que es dissocien completament per donar OH–ions en dissoldre's en aigua s'anomenen base forta. Alguns exemples inclouen NaOH. Les bases febles són aquelles que no es dissocien completament per alliberar OH–ió s'anomena base feble. Exemples de bases febles inclouen l'hidròxid d'amoni.
